
Resposta: B (verifique que a redação da questão apresentada coloca a alternativa "b" antes da alternativa "a")
Olá Juliana, boa noite! Como vai?
Para determinar a fórmula percentual é necessário calcular uma relação de massas, de cada elemento em relação à da substância. Assim, calcula-se a massa de cada elemento considerando a massa molar de cada um deles:
mC = 0,04 mol C . (12 g C/1 mol C) = 0,48 g C
mH = 0,08 mol H . (1 g H/1 mol H) = 0,08 g H
mO = 0,04 mol O . (16 g O/1 mol O) = 0,64 g O
Assim, a massa total dessa amostra da substância será a soma da massa dos seus elementos, ou seja, mamostra = 1,20 g.
Desse modo, calcula-se a percentagem de cada elemento considerando a massa de 1,20 g da amostra da substância. Assim.
%C = 0,48 g C / 1,20 g = 0,400 = 40,0%
%H = 0,08 g H / 1,20 g = 0,067 = 6,67%
%O = 0,64 g O / 1,20 g = 0,533 = 53,3%
Por sua vez, a fórmula mínima é a mínima relação molar entre os elementos da substância.
Uma vez que o enunciado já determinou essa relação, C0,04 mol H0,08 mol O0,04 mol, estabelecemos a proporção de 0,04 mol:0,08 mol:0,04 mol, ou seja, 1:2:1.
Sendo assim, a fórmula mínima dessa substância é C1H2O1 ou CH2O.
Considerando que a massa molar da substância é 2 vezes a massa molar da fórmula mínima (1 mol de CH2O terá massa de 30 g/mol), então sua fórmual molecular será C2H4O2 cuja massa molar é de 60 g/mol.
Observação: Caso fosse desejável propor uma fórmula estrutural, uma possível substância seria o ácido etanóico, ou ácido acético,

Contudo, poderia essa substância corresponder a isômeros estruturais do ácido acético, como
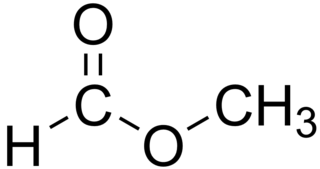
Espero ter contribuído com seus estudos!
Abraços,
André
