Olá Henrique, tudo bem?
Uma solução de cloreto de cobalto está submetida ao seguinte equilíbrio:
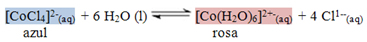
Os compostos coloridos são complexos. Quando o Cobalto 2+ se coordena com íons cloreto, fica azul, e quando ele se coordena com moléculas de água, fica rosa. Sendo frutos de um equilíbrio químico, esses produtos (os compostos azul e rosa) podem ter sua formação favorecida de algumas maneiras. Uma delas, por exemplo, é aumentar ou diminuir a concentração de uma das espécies envolvidas no equilíbrio. Segundo o princípio de Le Chatelier, essa perturbação gera uma tendência de se reestabelecer o equilíbrio da reação.
Então, se eu adiciono NaCl, ou seja, íons cloreto (que estão presentes no segundo termo da reação acima), desloco o equilíbrio no sentido de consumir esse excesso de cloreto, e portanto da formação do complexo de cobalto com cloreto, ficando então a solução azul.
Se eu adiciono o AgNO3, eu tenho íons Ag+ em solução, que irão precipitar o Cl-. Eles, portanto, removem o cloreto do equilíbrio. E assim, para reestabelecer o equilíbrio, a reação se desloca no sentido direto, formando mais íons Cl- e o complexo rosa. A solução, então, fica rosa.
No caso do agente higroscópico, trata-se de uma substância com alta capacidade de absorver água. Assim, ela vai remover as moléculas de água do sistema, deslocando o equilíbrio no sentido de reestabelecer a formação dessas moléculas. Portanto, o equilíbrio é deslocado no sentido inverso, dos reagentes, e forma-se o complexo azul.
Espero que tenha ajudado!
Qualquer problema, me procure!
Abraços,
Prof. Daniela

