Para um bom entendimento e aplicação da volumetria de oxidação-redução é necessário que se tenha solidificado os conceitos da eletroquímica também.
Dentro desse contexto podemos apontar um fato bastante corriqueiro em nosso dia a dia, que é a corrosão de metais. As reações de corrosão acontecem, de maneira espontânea, quando um metal é atacado por alguma substância e convertido em um composto não desejado. Um bom exemplo é a ferrugem, que nada mais é que a corrosão do ferro.
A ferrugem requer tanto oxigênio quanto água, e o processo pode ser acelerado por outros fatores, como: pH, presença de sais e desgaste do ferro (BROWN et al., 2016).
Com base nos estudos da eletroquímica, responda as seguintes questões:
a) Tendo as duas semirreações que mostram o processo espontâneo de ferrugem (corrosão do ferro), indique qual delas ocorre no cátodo e qual ocorre no ânodo: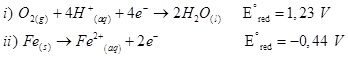
b) Para proteger o ferro do processo corrosivo, é possível fazer um revestimento com outro metal. Dessa forma, evita-se que a água e o oxigênio atinjam a superfície do ferro. Para essa finalidade é necessário que o metal de revestimento seja mais fácil de oxidar que o ferro. Com base na Tabela 1, de valores de potenciais padrão de redução, qual metal (ou metais) você escolheria para essa finalidade (revestimento)? Justifique sua resposta.