Para realizar o experimento, os estudantes transferiram 10 ml da amostra de vinagre para um balão volumétrico de 100 ml e completaram o volume com a água destilada. Em seguida, transferiram 10 ml da solução preparada no balão para um Erlenmeyer de 125 ml. No Erlenmeyer, adicionaram 3 gotas de fenolftaleina e 50 ml de água destilada. Posteriormente, a amostra contida no Erlenmeyer foi titulada com uma solução padronizada de NaOH a 0,1 mol/L até atingir o ponto de equivalência. Ao atingir o ponto de equivalência o volume foi de 9,3.O procedimento foi realizada em triplicata, ultizando um volume médio de 7,5 ml de NaOH 0,1 mol/L.
Após o tratamento dos dados experimentais os estudantes constataram que a porcentagem e a concentração molar do ácido acético na amostra de vinagre analisada eram, respectivamente:
CH3COOH(aq) + NaOH(aq) ? NaCH3COO(aq) + H2O(l)
( 1 mol ) ( 1 mol )
 No balão:
No balão: 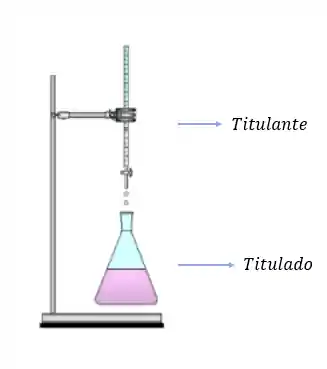 No sistema de titulação:
No sistema de titulação:
Amostra do vinagre = 10 ml + 90 ml água destilada = Volume Final = 100ml (solução) Bureta: Concentração molar NaOH = 0.1mol/L
Volume NaOH = 7,5 ml (média da triplicata) no ponto de equivalência.
Erlenmeyer: Concentração molar CH3COOH = ?
Volume do Vinagre = 10ml
Conforme a equação acima, o ácido acético (CH3COOH) vai reagir com hidróxido de sódio (NaOH), produzindo acetato de sódio (NaCH3COO) e água (H2O). A proporção de ácido acético 1 mol é igual a do hidróxido de sódio 1mol, logo o nº de mols gasto de NaOH na titulação será igual ao nº de mols de ácido acético presente no vinagre da amostra. Assim, para calcular o nº de mols do NaOH usado na titulação:
n = m x v ? Calculando o nº de mols de NaOH ? n= 0,1mol/l x 0,0075l (7,5ml) ? 0,00075 mol de NaOH gastos na titulação - isso significa que será igual ao nº de mol de ácido acético no erlenmeyer.
Calculando a concentração molar de CH3COOH ? n= m/v ? n= 0,00075 mol / 0,01L (10 ml) ? n= 0,075 mol/L de ácido acético na amostra de 10ml retirado do balão volumétrico.
Agora vamos descobrir a conentração de ácido acético no vinagre puro:
M(inicial) x V (inicial) = M(final) x V (final) ? Mi x 10 ml = 0,075 mol x 100ml ? Mi = 0,075 mol x 100ml / 10 ml ? Mi = 0,75 mol/L de ácido acético no vinagre. Agora transformando essa concentração em g/L
C = m (mol) x M(g) ? C = 0,75 mol/L x 60g (24g de C + 4g de H + 32g de O = 60g) ? C (g/L) = 45g/L.
Agora precisamos calcular o título (porcentagem) ? Título (%) = C(g/L) / d (densidade) x 1000 ? Título (%) = 45 / 1 x 1000 ? Título (%) =0,045 x 100% = 4,5 % de ácido acético no vinagre.
Após o tratamento dos dados experimentais os estudantes constataram que a porcentagem e a concentração molar do ácido acético na amostra de vinagre analisada eram, respectivamente:
0,75 mol/L de ácido acético no vinagre e 4,5 % de ácido acético no vinagre


Boa tarde, essa questão trata-se de um exercício de volumeria de neutralização. Para esse modelo de exercíco, é indicado fazer os cálculos de concentrações.
Primeiramente, é necessário montar a reação química;
CH3CH2OH(aq) + NaOH(aq) = CH3CH2NaO (aq)+ H2O(l)
Percebe-se que a estequiometria é de 1:1, ou seja, 1 mol do Ácido Acético está para 1 mol de NaOH. Realizando os cálculos, da titulação a concentração de NaOH foi de 0,1 mol/l com um volume médio de 7,5 ml.
Realizando os cálculos;
n CH3CH2OH = n NaOH
O número de mols pode ser calculado pelas duas formas; n = m/MM ou n=C*V, substituindo os valores;
m/MM = C*V
m/60(g)= 0,1 ( mol/l)* 7,5*10^-3(l)
m= 60 * 0,1*7,5*10^-3= 0,045 g CH3CH2OH
