Um exemplo de ácido fraco é o ácido oxálico (H2C2O4) cuja equação de ionização está representada pelo equilíbrio a seguir:
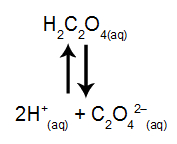
Analisando o equilíbrio acima, qual entre as substâncias propostas a seguir seria capaz de deslocar esse equilíbrio no sentido de favorecer a ionização do ácido?
a) NH4Br.
b) HBr.
c) NaI.
d) K2CO3.
e) H2O.
Obs: Qual a explicação para ser a letra D? Por que não poderia ser água , visto que o OH^- tem afinidade com o H^+?
Você pode pensar pelo fato do que favorece a ionização ser o consumo de algum ou dos dois produtos, deslocando o equilíbrio no sentido direto. No caso da questão, quem reagiria com os íons provenientes de um ácido? Íons provenientes de uma base, não é? Porém não temos uma base "convencional" (com presença de OH-) nas respostas. Então vamos analisar o que temos:
O NH4Br, que é um sal ácido.
O HBr que é um ácido forte.
O NaI que é um sal neutro.
A água, neutra também. E note a presença da água na ionização, ambos os lados estão na presença de água. Ela dissocia o ácido e não reage com ele, nesse caso.
Agora quando nós pensamos no K2CO3, temos um sal básico, que se proveniente de uma reação de neutralização, é produto da reação de uma base forte (KOH) e um ácido fraco (H2CO3).
Assim, que reagiria dentre as respostas, seria apenas o K2CO3.


