Considere as moléculas de CH4 (metano), NH3 (amônia)
e H2O (água). As três moléculas têm o mesmo arranjo
geométrico, porém têm ângulos de ligação diferentes.
Um estudante fez as seguintes observações a respeito
dessa situação.
I. A água tem menor ângulo de ligação porque
tem mais pares de elétrons não ligantes que
favorecem a diminuição de seu ângulo.
II. Os pares de elétrons não ligantes sofrem mais
atração nuclear, mantendo-se menos espalhados
que o par de elétrons ligantes.
III. O metano tem maior ângulo de ligação porque
seus pares de elétrons ligantes estão mais bem
distribuídos no arranjo geométrico.
Estão corretas as observações:
A) I e II, apenas.
B) I e III, apenas.
C) II e III, apenas.
D) I, II e III.
Gabarito B
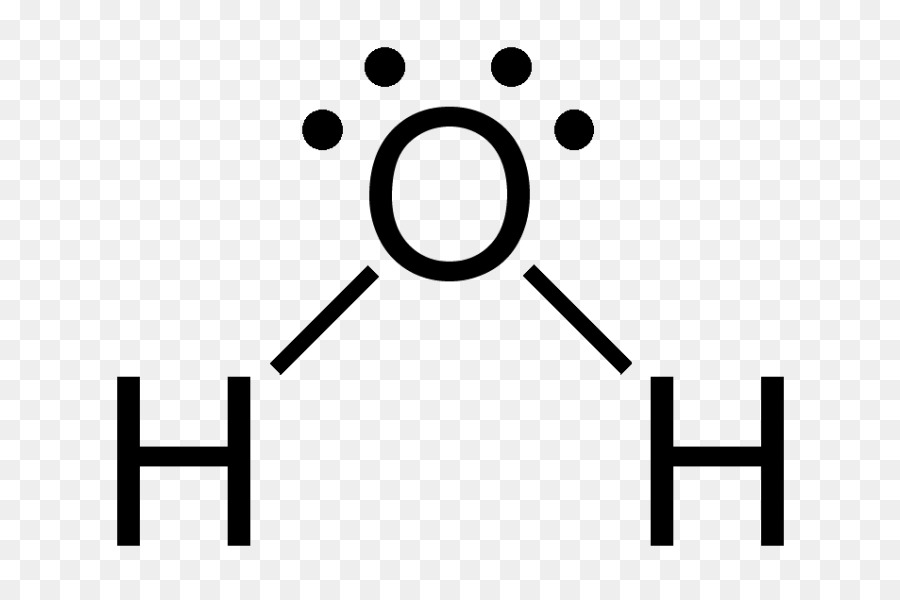 -> A água (H2O) como mostrado na estrura ao lado apresanta dois elétrons livres, os elétrons livres geram uma maior repulsão, "empurrando" os átomos, fazendo com que o ângulo seja menor, de aproximadamente 105°.
-> A água (H2O) como mostrado na estrura ao lado apresanta dois elétrons livres, os elétrons livres geram uma maior repulsão, "empurrando" os átomos, fazendo com que o ângulo seja menor, de aproximadamente 105°.
 -> A amônia (NH3) como mostrado na estrutura ao lado apresenta apenas um elétron livre, apresentando assim um ângulo intermediário entre os três compostos, de aproximadamente 107°.
-> A amônia (NH3) como mostrado na estrutura ao lado apresenta apenas um elétron livre, apresentando assim um ângulo intermediário entre os três compostos, de aproximadamente 107°.
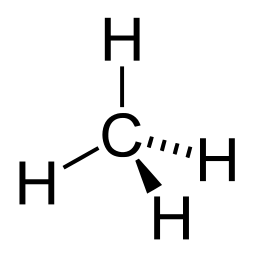 -> O metano (CH4) como mostrado na estrutura ao lado não apresenta nenhum elétron livre apresentando assim o maior ângulo entre os três compostos, de aproximadamente 109°.
-> O metano (CH4) como mostrado na estrutura ao lado não apresenta nenhum elétron livre apresentando assim o maior ângulo entre os três compostos, de aproximadamente 109°.
