


O Carbono está localizado na família IV-A, então, na sua camada de valência (última camada) têm 4 elétrons, necessitando de mais 4 ligações para alcançar o octeto e se estabilizar.
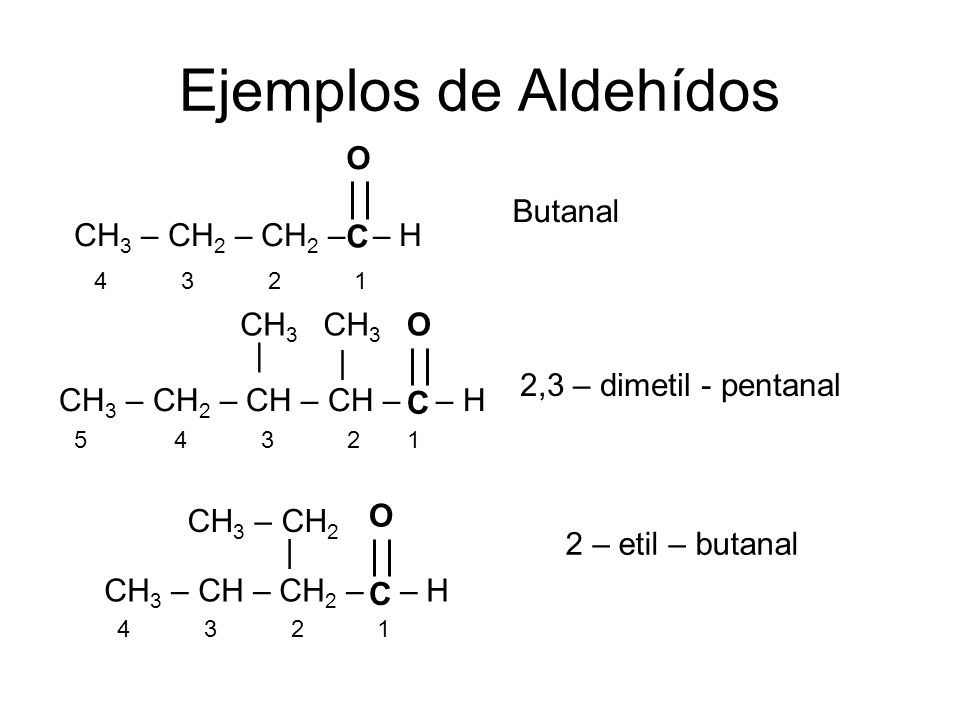
2,3-dimetil: indica que no Carbono2 e no Carbono3 estão radicais -CH3
pental-1-al: A cadeia carbônica possui 5 carbonos e no carbono1 está o grupo funcional, o qual é um aldeído (-CH=O).
1 2 3 4 5 : numeração da cadeia carbônica
O=HC - CH - CH - CH2 - CH3
| |
CH3 CH3
(metil)
Resumo:
Nº dos Carbonos com Ramificações - Nome do Grupo da Ramificação (Metil,Nitro..) - Prefixo Nº de Carbonos (met, et, prop, but..) - Infixo do Nº de ligações ( an (simples), en(dupla), in(tripla) ) - Função Orgânica

Olá Elisandra, boa noite!
Considerando a distribuição eletrônica do estado fundamental do átomo de carbono (6C: 1s2 2s2 2p2), o seu nível eletrônico mais energético (nível 2, ou 2ª camada eletrônica) possui 4 elétrons disponíveis para ligações químicas.
Assim, de acordo com os Postulados de Kekulé,
Assim, é possível que numa molécula o átomo de carbono realize, de acordo com a hibridização de seus orbitais,
etino (1 ligação simples e 1 ligação tripla);
propadieno (2 ligações duplas).
Assim, considere o hidrocarboneto a seguir, o propino, a cadeia carbônica apresenta 3 átomos de carbono tetravalentes, de modo que
Com relação à nomenclatura das substâncias orgânicas, deve-se analisar, fundamentalmente, os seguintes aspectos:
Uma vez identificado o grupo funcional, o átomo de carbono ao qual ele está ligado é o átomo de carbono principal, ao qual será atribuído o número 1, se estiver numa extremidade, ou o menor número possível. Assim, a numeração da cadeia carbônica sempre deve partir do átomo de carbono mais próximo do grupo funcional. Sendo um hidrocarboneto de cadeia aberta, deve-se iniciar a numeração pelo átomo de carbono da extremidade mais próxima de uma ligação tripla, ou dupla. Assim a ligação tripla tem prioridade sobre a ligação dupla. Caso todas as ligações sejam simples, deve-se iniciar a numeração pela extremidade mais próxima de uma ramificação, ou da maior ramificação, caso exista mais de uma.
Ainda, são determinadas regras a fim de diferenciar as diversas substâncias orgânicas atribuindo-lhes nomes específicos a fim de identificá-las. Fundamentalmente, o nome de uma determinada substância terá um:
Podem também ocorrer ramificações (cadeias carbônicas secundárias), também denominadas de radicais, que também indicam a sua quantidade de átomos de carbono, com o sufixo IL, antes do nome da cadeia principal. Alguns radicais tenham nomenclatura específica, decorrente da tradição. Caso uma mesma ramificação ocorra esteja presente mais de 1 vez, não se repete seu nome, e sim multiplica-se o seu nome. Assim, se uma cadeia carbônica principal apresentar duas ramificações "etila", utiliza-se o nome "dietil", em vez de "etil-etil", identificando os respectivos átomos de carbono da cadeia principal ao qual cada uma está ligada, ainda que seja no mesmo átomo de carbono. No entanto, se forem ramificações diferentes, identifica-se cada uma delas, escrevendo-as em ordem alfabética, identificando os respectivos átomos de carbono da cadeia principal ao qual estão ligadas. Ainda, podem ocorrer estruturas cíclicas, ou mesmo vários grupos funcionais, caracterizando estruturas mais complexas. Contudo, de modo geral, os 3 aspectos anteriomente listados são, na maioria dos casos, suficientes para a nomenclatura.
Isso posto, podemos considerar a seguinte tabela:

Desse modo, para a substância 2,3-dimetil-pentan-1-al, consideraremos os seguintes critérios:
Isso posto, o nome correto desse aldeído é 2,3-dimetil-pentanal e para escrever a sua fórmula estrutural deve-se:

Desse modo, a fórmula estrutural do aldeído 2,3-dimetil-pentanal é
Observações:
1) Apenas em estado de transição de reações de substituição pode ocorrer a formação de um átomo de carbono pentacovalente, mas essa estrutura existe apenas em estados de transição, ou seja, não são permanentes, ou estáveis.
2) A fórmula estrutural do aldeído 2,3-dimetil-pentanal também pode ser representada por
3) As ligações "pi" somente são formadas após a formação de ligações "sigma". Assim
Resumidamente,
5) As ligações do tipo "sigma" ocorrem através da sobreposição frontal de orbitais e são "mais fortes" do que as ligações do tipo "pi", que ocorrem pela interpenetração lateral de orbitais.
6) Para formar as ligações covalentes, o átomo de carbono sai do seu estado fundamental, 6C: 1s2 2s2 2p2, de modo que os elétros dos orbitais "2s" e "2p" formam estruturas híbridas de forma que podem gerar orbitais "2sp", ou seja, orbitais verdadeiramente híbridos, pois deixam de ser o orbital "2s" e os orbitais "2p".
Assim, pelo postulado de Kekulé, a valência desses elétrons é a mesma, e a única explicação é que eles tenham a mesma energia, o que justifica a formação de 4 orbitais "sp", ou seja, hibridização "sp3" (ou "s1p3"). Nesse caso, teremos 4 ligações covalentes "sigma", ou 4 ligações simples. Desse modo, não há mais elétrons no orbital "s", tampouco nos orbitais "p", mas apenas nos 4 orbitais ""sp", conforme a seguinte figura.
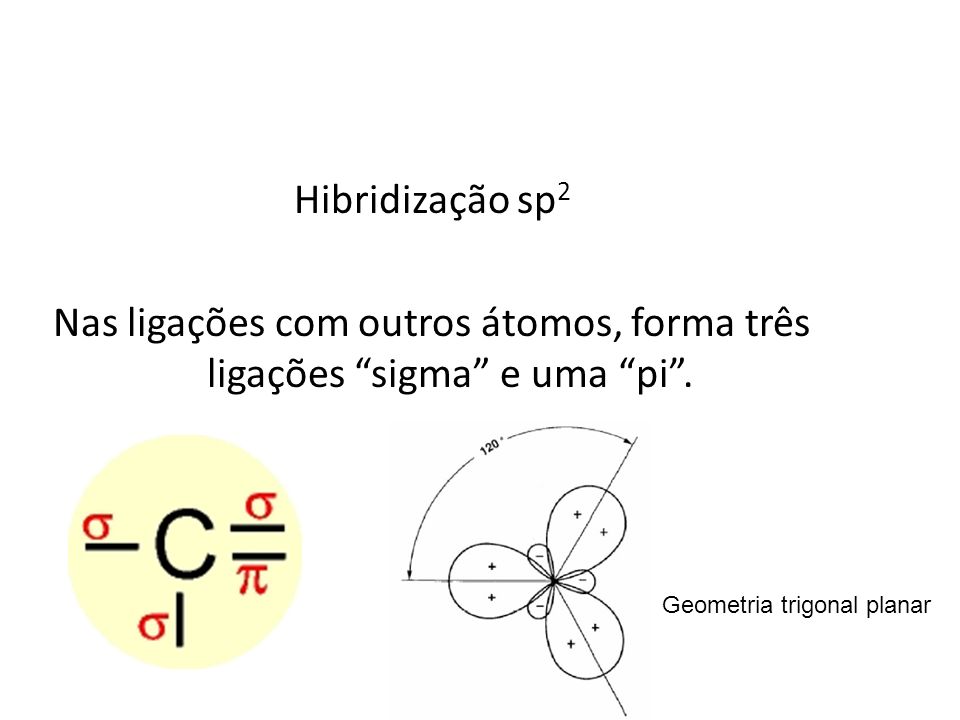
No entanto, há casos em que o átomo de carbono sofrerá uma reorganização eletrônica preservando 1 elétron em um orbital "p" "puro", ou seja, um orbital que não será misturado energeticamente com o orbital "s". Tem-se, assim, a hibridização "sp2" (ou "s1p2") na qual o orbital "s" e 2 orbitais "p" se reorganizam para formar 3 orbitais "sp", os quais formarão 3 ligações "sigma", enquanto o orbital "p" "puro" formará a ligação "pi".
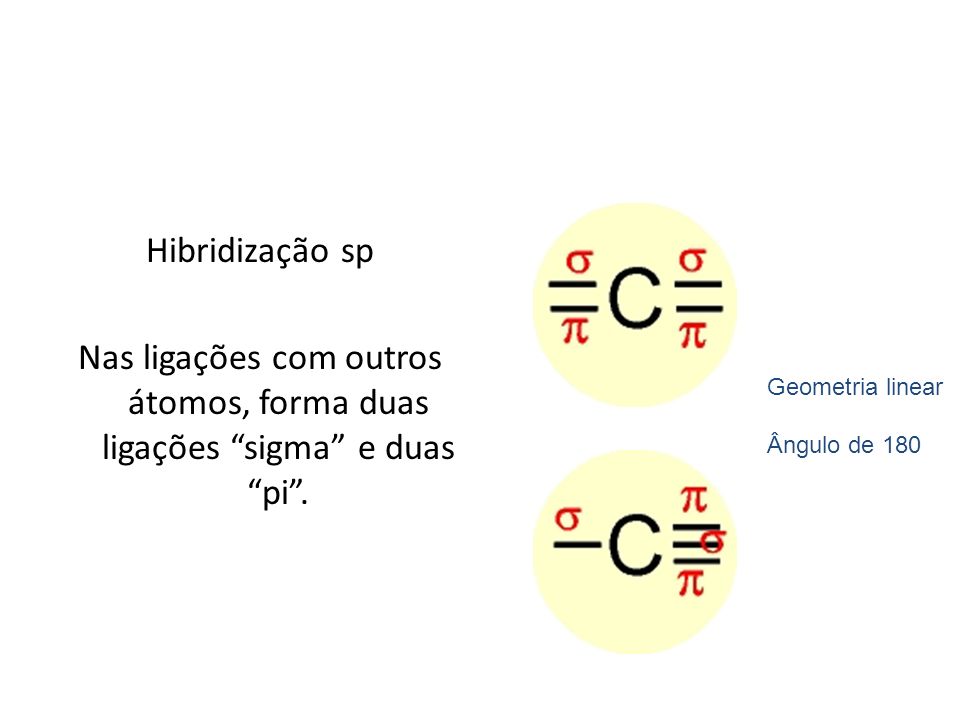
Sendo assim, conclui-se que, nos átomos de carbono, ligações "sigma" formam-se através de interações de orbitais "sp" e ligações "pi" de interações de orbitais "p" "puros".
Por fim, há substâncias que apresentam átomos de carbono com ligação tripla, ou duas ligações duplas condensadas no mesmo carbono. Nesse casos o átomo de carbono sofrerá uma reorganização eletrônica preservando 2 elétrons em 2 orbitais "p" "puros", ou seja, 2 orbitais que não serão hibridizados com o orbital "s". Tem-se, assim, a hibridização "sp" (ou "s1p1") na qual o orbital "s" e 1 orbital "p" se reorganizam para formar 2 orbitais "sp", os quais formarão 2 ligações "sigma", enquanto os orbitais "p" "puros" formarão 2 ligações "pi".
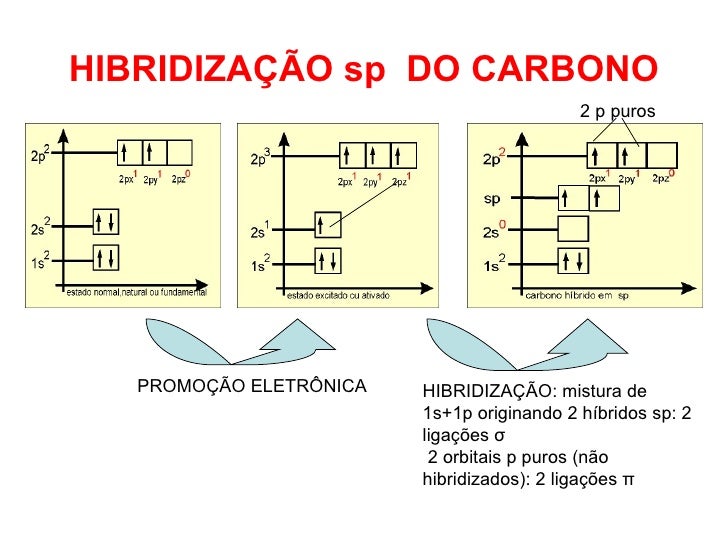
Bem, espero ter proporcionado uma explicação extensa para o assunto, pois compreender esses aspectos poderá ajudá-la a resolver uma grande quantidade de problemas de química orgânica. De todo modo, continuo à disposição para resolver quaisquer dúvidas que surjam.
Abraços,
André
