Observe a célula eletroquímica na figura a seguir:
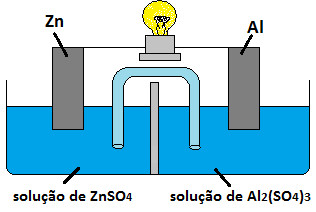
Indique a representação correta do ânodo e do cátodo dessa pilha:
a) Zn2+/Zn //Al/ Al3+
b) Zn+/Zn //Al/ Al3+
c) Al/ Al3+ // Zn2+/Zn
d) Al/ Al+ // Zn+/Zn
e) Al/ Al2+ // Zn2+/Zn
Por que é a letra C e por que o Al é cátodo e Zn é ânodo?
Em uma pilha, o ânodo representa o eletrodo negativo e onde ocorre o processo de oxidação.
Para saber quem é o ânodo e quem é o cátodo, precisamos dos potenciais padrão de redução. Eles são tabelados e devem ser fornecidos:
Zn(2+) + 2e- => Zn E° = -0,76 V
Al(3+) + 3e- => Al E° = -1,66 V
(Esses dados são do livro Physical Chemistry dos autores Atkins e Julio de Paula, 9ª edição)
Com esses dados, veja que o potencial de reduçã do Zn(2+) é maior, logo ele tende a se reduzir diante do Al(3+). Portanto, as semirreações são:
Redução (CÁTODO): Zn(2+) + 2e- => Zn
Oxidação (ÂNODO): Al => Al(3+) + 3e-

