Uma amostra de 30,695g de calcário (carbonato de cálcio) é aquecida a alta temperatura e se decompõe conforme a reação de calcinação
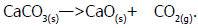
Após um aquecimento vigoroso, o calcário sofreu decomposição completa e depois de resfriado foi pesado e acusou 30,14g. Com base nestas informações, determine o volume de gás liberado na CNTP.
(DADO: C = 12, O = 16 , Ca =40)
Resposta: 0,282 L de CO2
Pela estequiometria da reação, é possível notar que 1 mol de Calcário libera 1 mol de CO2.
A massa de calcário inical é de 30,695 g. Depois do aquecimento, a massa dimunuiu para 30,14 g. Ou seja, houve um perda de 0,555 g de calcário. Deseja-se saber quanto é perda de massa corresponde ao CO2 liberado. Mas então iniciamente determinar o número de mols de calcário
n = m / MM
n = 30,695 / 100
n = 0,30695 mol de CaCO3
1 mol de CaCO3 ----------- 1 mol de CO2 --------- 1 mol de CaO
0,30695 mol de CaCO3 --- x mol de CO2 ---------- y mol de CaO
x = 0,30695 mol de CO2 = 13,5058 g de CO2
y = 0,30695 mol de CaO = 17,1892 g de CaO
Com a combustão completa, as massa residual seria somente de CaO (17,1892 g). Só que devido a nova pesagem, a massa pesada foi de 30,14 g. Ou seja, a diferença de massa é devido a nova absorção de CO2 do ar. Assim, 30,14-17,1892 = 12,9508 g de CO2 adsorvidos.
Então, na combustão completa, foi liberado 13,5058 g de CO2, e depois foi absorvido 12,9508 g de CO2, que dá uma diferença de 0,555 g de CO2 realmente liberadas. Calculando o número de mols, tempos:
n = 0,555/44
n = 0,01261 mol de CO2
Como se deseja saber o volume de gás na CNTP, 1 mol de gás possui o volume de 22,4 L. Nesse sentido:
1 mol de gás ---------- 22,4 L
0,01261 mol de gás -- z
z = 0,2825 L de CO2


Olá ! A reação em questão é:
CaCO3--->CaO + CO2
Volume molar de gases na CNTP: 22,4 L/ mol.
massa molar do CO2= 44 g/mol
Pela reação, vemos que para cada 1 mol de calcário que se decompõe, forma-se 1 mol de gás carbônico (CO2).
A massa de calcário antes do processo é de 30,695g e após o processo é de 3,14g. A diferença entre essas duas massas é de 0,555g que corresponde a massa de gás carbônico liberada.
1 mol de CO2 ----- 44g
X----------0,555
x = 0,0126 mol de CO2
1 mol de CO2------22,4L
0,0126------------x
x= 0,282 L de CO2
