A ideia da existência de átomos, os constituintes básicos da matéria, surgiu na Antiguidade. Os primeiros registros da concepção de átomo datam entre os séculos IV e V a. C., sendo estes relatos elaborados em Escolas de Filosofia na Grécia e na Índia. De fato, a palavra átomo é originada da palavra grega atomon, a qual significa “indivisível”. Assim, pode-se considerar a ideia de átomo proposta pelos gregos como o primeiro modelo atômico. Segundo os gregos antigos, os átomos eram unidades imutáveis e indivisíveis que existiam em infinitas formas e tamanhos, de modo que as combinações entre esses átomos originavam tudo o que existia no nosso mundo. De certa forma, essa ideia inicial sobre o que é um átomo não está totalmente distante da concepção que temos atualmente. Porém, devido à incapacidade de ser submetido a testes experimentais, o conceito de átomo foi considerado por grandes filósofos, como Aristóteles, apenas uma especulação, o que acabou tornando-o uma ideia rejeitada.
Desde então, por séculos, nenhum trabalho significativo sobre o átomo foi feito e sua concepção ficou esquecida até por volta dos séculos XVI e XVII, quando o Renascimento explodiu na Europa e, com ele, veio o surgimento do método científico. Assim, nesse período, diversas ideias inicialmente propostas na Antiguidade foram resgadas e lapidadas e, dentre elas, estava o conceito do átomo. O avanço do desenvolvimento do método científico permitiu que o átomo pudesse ver investigado de forma mais rigorosa e, a partir disso, novos modelos atômicos puderam ser elaborados com fundamentos em observações experimentais.
- O Modelo Atômico de Dalton
O primeiro modelo atômico baseado em observações experimentais foi proposto pelo químico inglês John Dalton, no início do século XIX. Ao estudar as propriedades físicas de gases, Dalton conseguiu observar experimentalmente o princípio descrito pela Lei da Conservação das Massas e, a partir disso, propôs um modelo que descrevia a matéria considerando sua constituição baseada em átomos. Dalton, então, postulou que todos os elementos são constituídos por átomos, partículas indivisíveis muito pequenas que não podem ser destruídas nem criadas, mas que podem ser rearranjadas em combinações diferentes, originando novas substâncias.
- O Modelo Atômico de Thompson
Apesar de simples, o Modelo Atômico de Dalton impulsionou investigações mais profundas sobre os átomos. Desta forma, no final do século XIX, o físico inglês Joseph Thompson, durante seus estudos sobre campos elétricos, descobriu a existência de cargas negativas na estrutura do átomo. Sem saber da dimensão da sua descoberta, Thompson havia observado experimentalmente evidências da existência do elétron, a primeira partícula subatômica identificada. Thompson, então, propôs um novo modelo para descrever o átomo, o Modelo Atômico de Thompson, conhecido como Modelo do Pudim de Passas. Segundo o Modelo Atômico de Thompson, o átomo era formado por uma esfera com carga positiva, a qual era incrustada por partículas negativamente carregadas, os elétrons. Uma representação do átomo segundo o Modelo Atômico de Thompson está na Figura 1.

Figura 1. Representação do átomo segundo o Modelo Atômico de Thompson.
- O Modelo Atômico de Rutherford
Com o rápido avanço da ciência moderna, novas tecnologias surgiram e permitiram estudos mais elaborados sobre a estrutura do átomo. Assim, no início do século XX, o físico neozelandês Ernest Rutherford, por meio de estudos usando radiação alfa, concluiu que os átomos continham uma pequena região que concentrava toda a carga positiva do átomo, o núcleo atômico, e que, em sua grande maioria, o átomo era formado por um espaço vazio no qual se encontravam os elétrons no entorno do núcleo atômico. Rutherford, então, desenvolveu o Modelo Atômico de Rutherford, o qual é uma analogia ao Sistema Solar, de modo que o Sol seria o núcleo atômico e os planetas corresponderiam aos elétrons. Uma representação do átomo segundo o Modelo Atômico de Rutherford está na Figura 2. No mesmo período, Rutherford também conseguiu observar experimentalmente a existência do próton e pôde concluir que o próton é uma partícula com carga positiva presente no núcleo atômico de todos os elementos.

Figura 2. Representação do átomo segundo o Modelo Atômico de Rutherford.
- O Modelo Atômico de Bohr
Também no início do século XX, a Mecânica Quântica estava surgindo a partir dos trabalhos de cientistas como Albert Einstein e Max Planck. Assim, como diversos fenômenos ainda não podiam ser explicados pelos modelos atômicos até então propostos, o físico dinamarquês Niels Bohr incrementou o Modelo Atômico de Rutherford ao incluir alguns princípios da Mecânica Quântica. Bohr, então, desenvolveu o Modelo Atômico de Bohr e a principal modificação feita em relação ao Modelo de Rutherford foi a proposta de que os elétrons orbitavam o núcleo atômico em órbitas estacionárias com níveis de energia definidos. Uma representação do átomo segundo o Modelo Atômico de Bohr está na Figura 3.
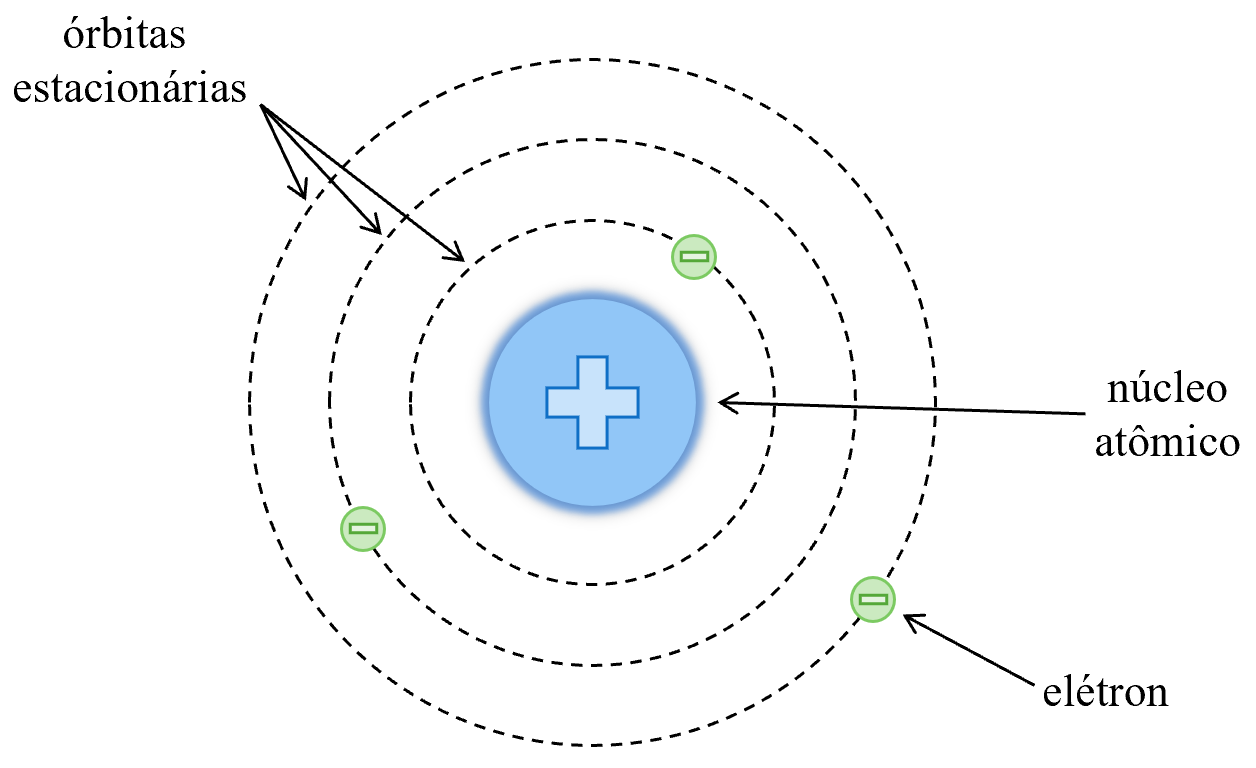
Figura 3. Representação do átomo segundo o Modelo Atômico de Bohr.
- O Modelo Atômico Quântico
A consideração dos elétrons ocuparem órbitas estacionárias com níveis de energia definidos no Modelo Atômico de Bohr foi uma inovação que pôde explicar diversos fenômenos, como o Efeito Fotoelétrico. Contudo, o Modelo Atômico de Bohr, apesar de incluir alguns princípios da Mecânica Quântica, ainda não era suficiente para explicar alguns fenômenos experimentais. Desta forma, à medida que a Mecânica Quântica foi amadurecendo, outras proposições foram elaboradas, como a dualidade onda-partícula do elétron, o Princípio da Incerteza de Heisenberg e a Equação de Schrödinger, e incluídas nas modelagens que descreviam a estrutura atômica.
Nesse contexto, a partir do final da década de 1920, o átomo passou a ser visto quase exclusivamente por uma perspectiva da Mecânica Quântica, o que levou ao desenvolvimento do Modelo Atômico Quântico, o qual é usado atualmente. Neste modelo, o elétron passa a ser considerado uma entidade que se comporta tanto como partícula quanto como uma onda e, desta forma, ele passa a ser descrito por equações matemáticas, chamadas funções de onda. Essas equações modulam o comportamento dos elétrons na estrutura atômica, permitindo a descrição de regiões no átomo em que se é possível encontrar os elétrons. Essas regiões são chamadas de orbitais atômicos. Uma representação do átomo segundo o Modelo Atômico Quântico está na Figura 4. O Modelo Atômico Quântico é abordado com mais detalhes em outro artigo deste blog.

Figura 4. Representação do átomo segundo o Modelo Atômico Quântico.
Na mesma época, o nêutron, partícula que também compõe o núcleo atômico, foi descoberto pelo físico inglês James Chadwick, o qual observou que o nêutron era uma partícula eletricamente neutra (sem carga) com massa semelhante a do próton. Nas décadas seguintes, com o desenvolvimento da Física Nuclear, o núcleo atômico foi bastante investigado e propostas de modelos que descrevem unicamente a estrutura do núcleo atômico foram feitas. Este conteúdo é abordado com mais detalhes em outro artigo deste blog.

