Você já ouviu falar na Lei da conservação das massas ou lei de Lavoisier? Sabe como ela surgiu e qual sua importância para a história da química?
Hoje vamos falar sobre um dos maiores nomes da ciência, o pai da química moderna, o Francês Antoine-Laurent de Lavoisier
Um breve histórico
Em meados do século XVIII uma das teorias mais aceitas sobre o processo de combustão era a teoria do flogístico. Segundo essa teoria, os materiais combustíveis, como papel, madeira, enxofre, carvão e óleos vegetais, possuíam um princípio comum inflamável presente apenas nos materiais combustíveis, o flogístico. Se algum material não queimasse, é porque não teria flogístico em sua composição, como por exemplo pedras e água.
A pesar de parecer simplória, ela conseguia explicar 3 fenômenos bem conhecidos da época a combustão, calcinação e a corrosão. Segundo essa teoria na combustão o flogístico saia do corpo e passaria para o ar, que faria o papel de transporta-lo para outro corpo. Assim se um corpo em combustão fosse abafado, o fogo cessaria, pois, o flogístico não teria para onde ir.
Foi quando Antoine Lavoisier viu um ponto fraco da teoria. Lavoisier foi um dos primeiros a inserir o uso da balança nos experimentos e era conhecido por ser muito meticuloso. Ao calcinar mercúrio metálico ele percebeu que a massa do produto final era maior que a do reagente em ambiente aberto. Se o flogístico saia do mercúrio na queima, como a massa do produto era maior que a do reagente? Hoje sabemos o produto é o oxido de mercúrio.
Anos depois Lavoisier propôs que a combustão não ocorria pela presença de flogístico, mas sim pela reação do material com oxigênio. Para Lavoisier, a combustão seria o resultado da combinação do oxigênio com o material que queimava.
Se o mesmo processo fosse realizado em ambiente fechado a massa antes e depois era a mesma. Além disso Lavoisier descobriu que o oxigênio estava presente na própria água, que até então acreditava-se ser um elemento. Tudo era pesado antes e depois e seus resultados eram sempre associados a ganho e perda de massa. Baseado nisso Lavoisier propôs sua lei ponderal, a lei da conservação das massas.
As leis ponderais
As leis ponderais são generalizações matemáticas relacionadas as massas das substâncias envolvidas em uma reação química. Através das leis ponderais, podemos prever a massa dos produtos, ou calcular a massa de um reagente necessária para obter tal massa de produto. As leis ponderais são a base da estequiometria e tem aplicações práticas no dia a dia.
As leis ponderais mais importantes são:
I. Lei de Lavoisier ou da conservação da massa, ou de conservação da matéria;
II. Lei de Proust ou das proporções constantes, ou das proporções definidas, ou das proporções fixas ou invariáveis;
III. Lei de Dalton ou das proporções múltiplas.
Neste blog iremos focar apenas na Lei de Lavoisier e sua importância. Em uma próxima oportunidade falaremos das demais.
Lei de Lavoisier
Lavoisier provou com o uso da balança que a conservação da massa é uma lei da natureza, ou seja, as reações químicas são transformações que levam a produtos cuja massa total é igual a massa dos reagentes. A sua lei pode ser entendia pela sua experiencia sobre a natureza da água e pela combustão do mercúrio.
Experiência da combustão do mercúrio.
Na época o uso de balanças e vidrarias em experiências estava se difundindo. Sabia-se que se uma amostra de mercúrio fosse calcinada ela formava um sólido vermelho cuja massa era maior que da amostra original. Esse tipo de experimento induzia os cientistas a pensar que a massa estava sendo criada. Porém Lavoisier refez este experimento em recipiente fechado obtendo constatações que levaram a formulação de uma lei que veio a revolucionar a ciência da época.
Para tanto Lavoisier pesou uma amostra de mercúrio e colocou dentro de uma retorta que estava em cima de um forno. Essa retorta foi conectada a uma redoma contendo também uma quantidade de mercúrio e o restante de ar. Todo o sistema foi pesado cuidadosamente antes do forno ser ligado.
Após deixar a retorta em aquecimento por tempo suficiente, duas coisas aconteciam. O nível de mercúrio na retorta diminuiu, sendo substituído por um sólido vermelho e o nível de mercúrio na redoma subiu, ocupando o espaço que era do ar.
Ele pesou o sistema e constatou que a massa final era a mesma da massa inicial. Não houve ganho ou perda de massa mesmo com as transformações.
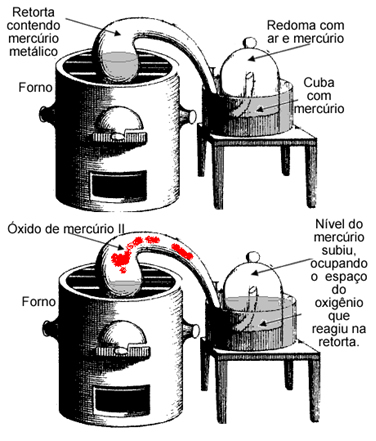
Assim, era óbvio que o mercúrio havia reagido com algum constituinte do ar tanto na retorta quanto na redoma, formando o solido vermelho que hoje sabemos ser o óxido de mercúrio II. Hoje sabemos que ele reagiu não com todo o ar que estava ali, mas sim com o oxigênio, como ocorre em todas as combustões.
Experiência da decomposição da água.
Onze anos mais tarde, em 1783, Lavoisier descobriu que a água é uma substância formada por dois elementos: hidrogênio e oxigênio. Até então acreditava-se que a água era uma substância simples, ou seja, não podia ser decomposta.
Para conseguir decompor a água, Lavoisier contou com a ajuda de outro cientista, J. B. Meunier de Laplace. Eles passavam certa massa de vapor d’água sobre ferro incandescente, então conseguiam decompor a água em hidrogênio e oxigênio. Então esses gases eram coletados em um recipiente que ao acender uma centelha elétrica desencadeava uma reação de combustão gerando água novamente. Tudo era pesado a massa de água era a mesma antes e depois do processo.

Baseado nos resultados dessas duas experiências Lavoisier enunciou a lei de conservação das massas:
Se uma reação química é realizada em ambiente fechado, a soma das massas dos reagentes é sempre igual à soma das massas dos produtos.
Essa lei tem aplicações práticas em todas as áreas, não só na química. Se colocarmos uma quantidade de zinco metálico previamente pesada em uma quantidade de ácido clorídrico previamente medida saberemos a massa de gás hidrogênio que será formada, graças a Lei de Lavoisier.
Se você gostou desse blog, visite meu perfil e deixe uma avaliação! :)



