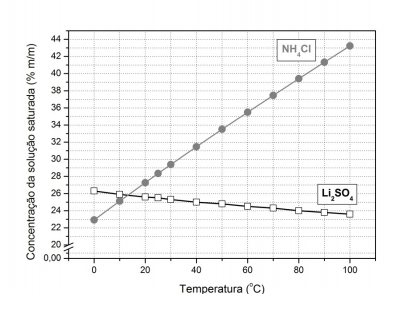
O gráfico abaixo mostra a variação nas concentrações de soluções saturadas de dois sais em água, Li2SO4 (reta descendente) e NH4Cl (reta ascendente), individualmente, em função da variação na temperatura da solução. A concentração é expressa em termos de percentual massa/massa, ou seja, a massa do sal dissolvido em 100 g da solução.
DUVIDAS:
08. a solubilidade do sulfato de lítio seria maior em uma solução contendo Na2SO4 do que em água pura.
16. em água a 0 ºC, a concentração molar de uma solução saturada de sulfato de lítio é maior que a concentração molar de uma solução saturada de cloreto de amônio.
32. em água a 50 ºC, é possível dissolver 30 g de sulfato de lítio, mas não é possível dissolver completamente 30 g de cloreto de amônio.
Envie sua primeira dúvida gratuitamente aqui no Tira-dúvidas Profes. Nossos professores particulares estão aqui para te ajudar.
08. FALSO. Podemos calcular a solubilidade máxima de um sal com base em seu Kps (produto de solubilidade). Cada sal tem o seu próprio Kps para uma dada temperatura.
Vamos expressar a solubilidade "s" em mol/L do Li2SO4 em água pura:
Li2SO4 -> 2 Li + SO4 (não esqueça que o Li tem carga + e o SO4 carga 2-)
s 0 0 início
-s +2s +s reação
0 2s s final
Kps = (2s)². s = 4.s³ => s = cbrt(Kps)
Vamos fazer o mesmo processo, com a diferença de que há uma concentração inicial C de SO4, por conta da dissolução prévia do sulfato de sódio:
Li2SO4 -> 2 Li + SO4
s 0 C início
-s +2s +s reação
0 2s C+s final
Kps = (2s)².(C+s) = 4.s³ + 4.s².C => Percebe-se que s será menor que antes, pois há um termo 4.s².C acompanhando o antigo 4.s³ para dar o mesmo resultado.
16. FALSO. A concentração molar é medida em mol/L, portanto devemos calcular quantos mols há de cada sal em 1L de água a 0°C: há 1000g de água em 1L
Massa molar Li2SO4: 110 g/mol
Massa molar NH4Cl: 53,5 g/mol
massa de Li2SO4 em 1000g de água: 26% = m/1000 => m = 260g
massa de NH4Cl em 1000g de água: 23% = m'/1000 => m' = 230g
mols de Li2SO4: n = m/110 = 260/110 = 2,36 (aprox)
mols de NH4Cl: n' = m'/53,5 = 230/53,5 = 4,3 (aprox)
n'>n , portanto a concentração molar de NH4Cl é maior, apesar da massa presente ser menor.
32. FALSO. O enunciado não especificou a massa de água em questãopara as dissoluções. Com quantidade suficiente de água pode-se dissolver 30 g dos dois sais.
Envie sua primeira dúvida gratuitamente aqui no Tira-dúvidas Profes. Nossos professores particulares estão aqui para te ajudar.
Envie sua primeira dúvida gratuitamente aqui no Tira-dúvidas Profes. Nossos professores particulares estão aqui para te ajudar.